La Termodinamica è una scienza sperimentale basata su pochi principi derivanti da generalizzazioni dall’esperienza sperimentale. Si occupa solo di alcune proprietà macroscopiche della materia (P pressione, T temperatura, V volume) e non fa alcuna ipotesi circa la struttura microscopica della materia.
EQUIVALENTE MECCANICO DEL CALORE
Fino adesso abbiamo trattato il calore come una grandezza legata solamente a fenomeni di scambio termico, collegato alla grandezza temperatura.
In effetti nel passato esso era considerato come una grandezza fisica a se stante che si trasferiva da un corpo all’altro. In realtà il calore è una forma di energia e Joule, mediante un famoso esperimento, determinò l’equivalenza tra la caloria (la caloria è l’unità di calore che serve per fare innalzare la temperatura di un litro di acqua distillata da 14,5°C a 15,5 °C) e il lavoro meccanico trovando la seguente equivalenza:
1Cal. = 4,186 J
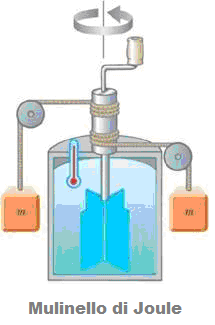
L’apparecchio che utilizzò (Mulinello di Joule) è raffigurato nella seguente figura:
Con tale apparecchiatura è stato possibile determinare l’equivalenza tra l’energia meccanica in gioco legata ai pesi che scendendo di quota percorrono un certo tratto, e l’energia termica legata al moto di agitazione dell’acqua prodotto dalle palette a contatto con essa e messe a loro volta in moto dei pesi.
ENERGIA INTERNA DI UN GAS
In tutte le trasformazioni reali l’energia meccanica posseduta da un corpo non si conserva: dopo una generica trasformazione, l’energia è sempre inferiore all’energia meccanica iniziale:
Emf < Emi
Una delle cause principali di dispersione dell’energia è dovuta agli attriti esistenti tra i corpi a contatto.
E’ facile verificare che gli attriti fra i corpi posti in movimento reciproco, producono un innalzamento della temperatura degli stessi.
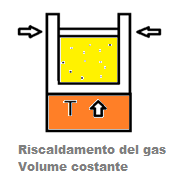
Un gas chiuso all’ interno di un sistema cilindro + pistone, con pistone bloccato in una certa posizione qualora posto a contatto con un corpo più caldo, assorbe una certa quantità di energia termica.
Visto che il sistema non può compiere lavoro meccanico, poiché ogni movimento è impedito, l’energia termica trasferita al gas si trasforma nella cosiddetta energia interna dal gas U.
Prendendo in considerazione un gas ideale, attraverso opportuni passaggi matematici, si determina l’energia interna:
U=3/2 n R T
Dove
- U= Energia Interna per un gas ideale
- n= Numero di moli
- R= Costante universale dei Gas
- T= Temperatura assoluta dei Gas
L’energia interna di un Gas ideale è legata solamente alla sua temperatura: più alto è il valore della sua temperatura maggiore sarà l’energia interna posseduta dal gas.
L’energia interna è correlata al moto di agitazione delle molecole costituenti il gas, ciò significa che maggiori valori di temperatura equivalgono a maggiori valori di velocità di traslazione delle molecole.
IL PRIMO PRINCIPIO DELLA TERMODINAMICA
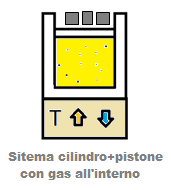
Consideriamo il nostro sistema cilindro + pistone con all’interno una certa quantità di gas ideale che rimane immutata.
La base del cilindro è poggiata su di un corpo di cui possiamo controllare a piacimento la temperatura.
Sappiamo già che fornendo calore al gas si può produrre lavoro attraverso la sua espansione e può variare anche la sua energia interna legata, come abbiamo visto, alla sua temperatura. Il primo principio della termodinamica si esprime attraverso la seguente relazione:
ΔU = Q – L
Dove:
- ΔU = Variazione di energia del gas
- Q = Calore fornito al gas
- L = Lavoro compiuto dal gas
I segni delle quantità che figurano nella formula riportata, vanno presi nel seguente modo:
- Q>0 Calore fornito al sistema
- Q<0 Calore ceduto dal sistema
- L>0 Lavoro compiuto dal sistema
- L<0 Lavoro subito dal sistema
Il primo principio della termodinamica è di fatto una espressione che lega energie di una natura diversa e ne esprime la reciproca trasformazione.
ESERCIZIO
Un gas assorbe 1500 J di calore ed, espandendosi compie un lavoro di 700 J.
Calcola la variazione di energia interna del gas.
Alla fine della trasformazione la temperatura del gas è aumentata o diminuita?
Q= 1500 J
L=700 J
ΔU= Q-L= 1500-700= 800 J
Come si può vedere solo una parte del calore fornito nel sistema si trasforma in lavoro meccanico:
700/1500 x 100 = 46%
La temperatura è aumentata perché aumenta l’energia interna.
LA MACCHINA TERMICA
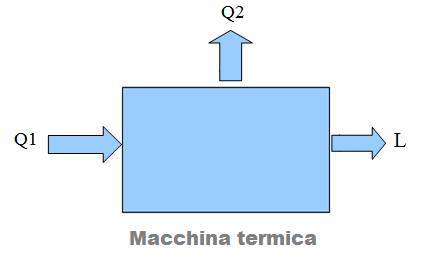
Lo schema riportato in figura rappresenta una semplificazione del funzionamento della macchina termica.
- Q1 = Energia termica fornita alla macchina
- L= Lavoro meccanico compiuto dalla macchina
- Q2 = Calore rilasciato dalla macchina all’ambiente
Ѐ una costatazione di fatto che qualsiasi macchina termica rilascia sempre una parte del calore fornito all’ambiente, senza che esso possa essere trasformato in lavoro utile.
Si definisce rendimento di una macchina termica il seguente rapporto:
Ŋ= L / Q1
In un ciclo chiuso il valore dell’energia interna anche se varia durante la trasformazione, ritornando al punto di partenza assume lo stesso valore di partenza.
Applichiamo ora il I principio della termodinamica al ciclo chiuso:
ΔU = Q – L = 0
L = Q
Q = Q1 – Q2
Ŋ = (Q1 – Q2) / Q1 = 1 – Q1/Q2
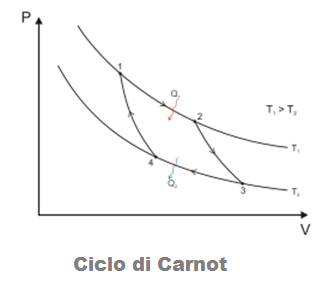
IL CICLO DI CARNOT
Un ciclo particolarmente importante nello studio della termodinamica ed in particolare delle macchine termiche è il ciclo di Carnot.
Esso è costituito da due trasformazioni isoterme e due adiabatiche (senza scambio di calore con l’ambiente).
Ipotizziamo di partire dal punto 1:
1° Trasformazione 1-2: (Isoterma)
In tale trasformazione, che avviene a temperatura costante, il gas si espande grazie al calore Q1 che viene fornito al sistema.
Quindi in questa fase il sistema compie lavoro.
2° Trasformazione 2-3: (Adiabatica)
In questa trasformazione il sistema viene completamente isolato dal punto di vista termico in modo che esso non possa scambiare calore con l’esterno. Il sistema continua ad espandersi compiendo lavoro fino al punto massimo di espansione in 3.
3° Trasformazione 3-4: (Isoterma)
In questa trasformazione il sistema cede calore Q2 all’ambiente, il gas si decomprime e quindi il sistema subisce lavoro.
4° Trasformazione 4-1 (Adiabatica)
Con l’ultima trasformazione il sistema si riporta nel punto di partenza, chiudendo quindi il ciclo attraverso una compressione del gas che quindi aumenta la sua temperatura.
Il lavoro compiuto dal sistema nell’intero ciclo è rappresentato dall’area racchiusa dal ciclo stesso.
Il rendimento di una macchina ideale che compie il ciclo di Carnot è dato da:
Ŋ= 1 – Q1/Q2
Si dimostra, attraverso opportuni passaggi, che il rendimento per tale ciclo è dato anche dalla seguente relazione:
Ŋ = 1 – T2/T1
Esempi
Con i seguenti valori di temperature, si ottengono i rendimenti:
T1 = 100
T2 = 50
Ŋ= 0,50 ( 50%)
T1 = 150
T2 = 50
Ŋ= 0,67 ( 57%)
Dalla relazione trovata si evince che qualsiasi macchina termica che lavori con le temperature estreme relative al ciclo di Carnot, potrà avere un rendimento al massimo pari a quello relativo al ciclo di Carnot.
In altri termini il rendimento della macchina ideale che funziona con il ciclo di Carnot rappresenta il limite massimo raggiungibile da una macchina.
Per aumentare il rendimento di una macchina termica è possibile agire secondo le seguenti alternative:
- Aumentare la temperatura del termostato che cede calore la sistema
- Diminuire la temperatura del termostato che assorbe calore dal sistema